Recuperamos esta serie de artículos dedicados a la química y a casos concretos donde podemos explicar conceptos interesantes tratando problemas reales. Esta vez hemos decidido ampliar una noticia sobre acidificación marina que apareció en nuestro programa 157. La acidificación marina no se ha tenido en cuenta hasta ahora, pero parece ser que comienza a ser un factor a valorar y como tal se empieza a estudiar su efecto ambiental porque está afectando a una actividad industrial como son los criaderos de ostras en el litoral de Oregón en Estados Unidos.
Lo importante no debe ser por qué han saltado las alarmas sino que ha saltado la alarma sobre un problema que no se trataba como factor determinante para la vida por los científicos. De hecho el sistema químico que trataremos en los próximos artículos se proponía desde algunos sectores como un buen sumidero de CO2 , gas de efecto invernadero y cuyo aumento de concentración en el aire está creando muchos problemas ambientales.
Lo importante no debe ser por qué han saltado las alarmas sino que ha saltado la alarma sobre un problema que no se trataba como factor determinante para la vida por los científicos. De hecho el sistema químico que trataremos en los próximos artículos se proponía desde algunos sectores como un buen sumidero de CO2 , gas de efecto invernadero y cuyo aumento de concentración en el aire está creando muchos problemas ambientales.
En la primera parte de esta serie de artículos, aclararemos conceptos sencillos pero necesarios para entender el sistema químico del gas CO2 en agua y como su disolución en los mares, lejos de ser una solución, es un problema. Así deberemos entender los conceptos de acidez y de equilibrio químico.
 |
S.P.L. Sørensen |
Así mediante la fórmula matemática pH= - log [H+] tendremos una relación entre la escala de pH y la concentración de este importantísimo catión. Si aumenta la concentración de protones disminuye el pH.
EQUILIBRIO QUÍMICO:
Un equilibrio químico es un sistema en el que coexisten reactivos y productos una vez se ha iniciado la reacción. Es decir que no todo los reactivos se convierten en productos y dependiendo de las condiciones esta conversión será en mayor o menor medida. Este fenómeno sucede porque la reacción se puede producir en ambas direcciones y cuando los reactivos y productos alcanzan concentraciones constantes se dice que están en equilibrio.
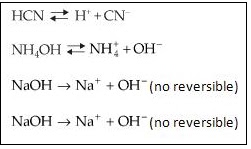
Dos ejemplos de equilibrio químico; primero la disociación del ácido cianhídrico y segundo de la hidroxilamina. Las otras dos reacciones son reacciones irreversibles.El ingeniero francés Le Châtelier fue quien describió estos sistemas con el principio que lleva su nombre.
 |
Henry Louis Le Châtelier |
Principio de Le Châtelier
Si un sistema químico en equilibrio reversible experimenta un cambio en concentración, temperatura o presión, el equilibrio del sistema se modificara en orden de minimizar dicho cambio
Los dos equilibrios mostrados anteriormente además son equilibrios ácido-base, es decir un equilibrio donde hay una reacción ácido-base, que son reacciones en las que se producen aumento de [H+] y por lo tanto aumento de acidez (descenso de pH) o como en la segunda reacción apareciendo [OH- ] que reaccionan con los protones retirándolos del medio, formando una molécula de agua y así descendiendo la acidez.

Ahora con estos dos conceptos podemos entender por qué la disolución de CO2 en agua produce acidez. Si el dióxido de carbono se disuelve en agua pasa a formar parte del equilibrio del ácido carbónico H2CO3 ácido que corresponde justo a la suma estequiométrica de CO2 y H2O. Pues bien resulta que este equilibrio tiene tendencia a desplazarse a la derecha para formar carbonatos que son el resultado de la pérdida por parte del ácido carbónico de protones. Como hemos comentado anteriormente si se produce un aumento de protones en el medio aumentará la acidez y bajará el pH.
Pues bien ya tenemos la explicación química de la acidificación de los Océanos por culpa del aumento del CO2 atmosférico que al disolverse en el agua desprende protones bajando el pH y acidificando nuestros mares. Como hemos comentado seguiremos las consecuencias de esta acidificación marina la semana próxima con otra entrega de esta serie de artículos que pretende acercar al ciudadano el fascinante mundo que nos rodea.








1 comentarios:
Con esto de la selectividad, me ha hecho recordar cuando estudié esto, allá por la selectividad de 1998...
Cojonudo este momento para explicar las reaciones, a ver si la gente reacciona :).
Publicar un comentario